Taxonomia
Estatutos de conservação
Distribuição geográfica
Morfologia
Ecologia
Reprodução
Principais Ameaças
Bibliografia útil
Taxonomia
Reino: Animalia
Filo: Chordata
Classe: Aves
Ordem: Falconiformes
Família: Accipitridae
Género: Aegypius
Espécie: A. monachus
Aegypius monachus (Linnaeus, 1766), original: Vultur monachus
Estatutos de conservação
- Global - IUCN (International Union for Conservation of Nature): NT (Quase ameaçado)
- Espanha: VU (Vulnerável)
- Livro Vermelho dos Vertebrados de Portugal: CR (Criticamente em perigo)
- SPEC (Species of European Conservation Concern): 1 – espécies ameaçadas globalmente
- Estatuto de ameaça EU25 (BirdLife International): raro
- Protecção legal:
Directiva Aves – anexo I e espécie de conservação prioritária no espaço europeu.
Convenção de Berna – anexo II.
Convenção de Bona (sobre a Conservação das Espécies Migradoras Pertencentes à Fauna Selvagem) – anexo II.
Convenção sobre o Comércio Internacional das Espécies da Fauna e Flora Silvestres Ameaçadas de Extinção (CITES) – anexo II-A.
Distribuição geográfica
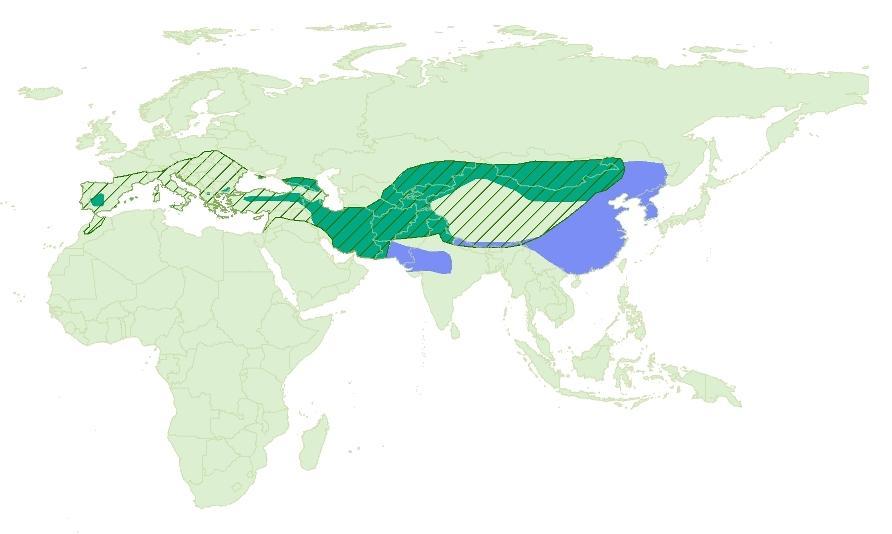
Na Europa está presente na Península Ibérica, incluindo Baleares, e nos Balcãs. Depois na Turquia, através do Cáucaso, Irão, Afeganistão até ao sul da Sibéria, Mongólia e norte da China e extremo norte da Índia. Populações invernantes até ao sul do Sudão, Médio Oriente, Paquistão, noroeste da Índia e Coreia.
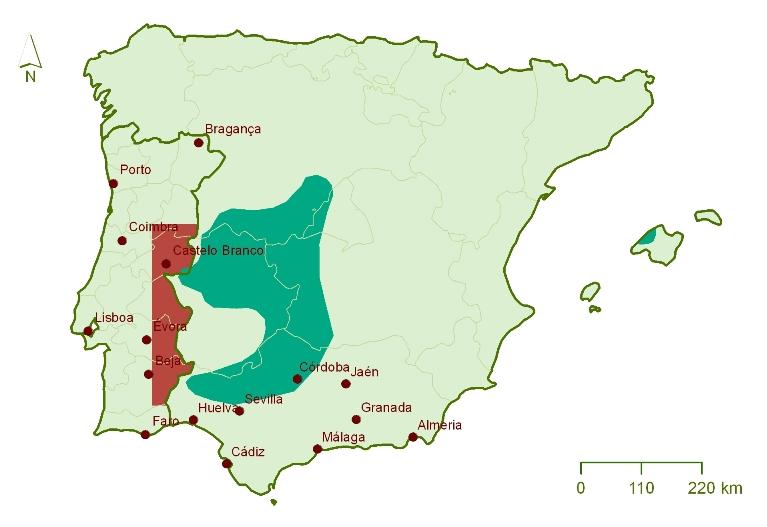
Em Portugal ocorre no Leste e Centro-Sul do território continental, ao longo da região fronteiriça do território continental entre Beira Baixa e o Baixo Alentejo, sendo um visitante esporádico na região do Douro Internacional. Depois de um declínio acentuado ao longo da primeira metade do séc. XX e de se ter extinguido como reprodutor nos anos 70, em 2010, 4 casais de abutre-preto voltaram a nidificar em Portugal, na região do Tejo Internacional, dos quais 2 tiveram sucesso reprodutor. Depende agora de todos reduzir as ameaças a esta espécie, o que pode permitir que esta imponente ave volte a ser comum nos nossos céus.
 |
Distribuição mundial do abutre-preto no início do século XX |
 |
Distribuição mundial de reprodução do abutre-preto (actual)
|
 |
Distribuição mundial de invernada / migração do abutre-preto (actual)
|
| Adaptado de del Hoyo 1994 |
 |
Área de reprodução do abutre-preto na Península Ibérica (de la Puente et al 2007) |
 |
Área de ocorrência regular do abutre-preto em Portugal (Equipa Atlas 2008) |
Morfologia
O abutre-preto é a maior ave de rapina da Europa, com cerca de 98-107 cm de comprimento e podendo atingir os 3 metros (250-300 cm) de envergadura. De plumagem escura, quase preta, este necrófago pode ser avistado a planar nos céus raianos, em busca de animais mortos para comer. A sua imensa silhueta escura, de asas quase rectangulares é imponente, sendo um verdadeiro privilégio avistar um destes animais, algures no Alentejo mais profundo.
Ecologia
O abutre-preto é uma espécie associada aos habitats Mediterrânicos, nidificando sobretudo em bosques de sobreiro (Quercus suber) ou azinheira (Quercus rotundifolia), quase sempre em zonas remotas e montanhosas, com declives acentuados e longe da presença do Homem. Cobrem diariamente dezenas de quilómetros, em busca de alimento. As áreas onde se alimenta dependem da disponibilidade de presas, mas o abutre-preto prefere alimentar-se em zonas de montado, e longe de fontes de perturbação humana. Ao eliminarem, de forma rápida e eficaz, as carcaças dos animais mortos no campo, os abutres evitam a propagação de doenças e asseguram o funcionamento da rede trófica do ecossistema.
Alimentam-se de carcaças preferencialmente de pequeno a médio porte, tendo como principais presas o coelho-bravo e as ovelhas e cabras das explorações agrícolas. Nas últimas décadas, devido à regressão das populações de coelho, os abutres-pretos passaram de uma alimentação quase totalmente baseada no coelho (anos 70) para uma alimentação à base de ovelhas (1998-2000), alimentando-se também de cabras, porcos e ungulados silvestres em menor escala.
Reprodução
Geralmente nidifica em colónias dispersas, quase sempre em árvores, sobretudo sobreiros, azinheiras e, em algumas regiões, pinheiros. Os ninhos são feitos de paus e troncos, atingindo 145-190 cm de diâmetro. A postura ocorre entre Fevereiro - Abril e é quase sempre de 1 ovo. Os abutres-pretos tornam-se adultos aos 3-6 anos de idade.
Principais Ameaças
São várias as ameaças que afectam as populações de abutre-preto: (1) envenenamento ilegal; (2) colisão ou electrocussão em linhas eléctricas aéreas; (3) abate ilegal; (4) redução da disponibilidade trófica devido à escassez do coelho-bravo, e a medidas sanitárias que obrigam a recolher todos os cadáveres de gado; (5) degradação do habitat de alimentação devido a práticas agrícolas, pastoris e silvícolas mais intensivas; (6) perturbação humana nas zonas de nidificação; (7) implantação de parques eólicos e de infra-estruturas hidráulicas perto de áreas de nidificação e instalação de barragens que reduzem o habitat de alimentação; (8) resíduos de medicamentos e de metais pesados (chumbo) nas carcaças do gado doméstico e/ou silvestre.
(1) Envenenamento
O envenenamento não dirigido, resultado do uso de iscos envenenados para o controlo ilegal de vertebrados, causa um decréscimo acentuado no número de abutres-pretos todos os anos. Apesar de ser proibido pela legislação internacional (Directiva Aves e Directiva Habitat da UE) e nacional (Decretos lei 316/89, 140/99, 202/04, 49/2005 e Lei 173/99), este método de controlo de predadores atinge um elevado número de espécies na Europa. Adicionalmente, existe o problema do uso não controlado de pesticidas químicos (podendo facilitar a ocorrência de doenças mortais ao reduzir a competência do sistema imunitário) e a ingestão de presas contaminadas com chumbo. Em Espanha, 98% dos casos de envenenamento por pesticidas são causados por uso ilegal e intencional desses pesticidas como veneno contra predadores. Aí, os pesticidas mais usados como venenos (88% dos casos) são o carbofurano, a estricnina e o carbonato Aldicarb.
(2) Colisão e electrocussão em linhas eléctricas
Os acidentes envolvendo infra-estruturas eléctricas são uma das principais causas de mortalidade não natural em aves. Em Espanha detectaram-se 34 casos de mortalidade em abutre-preto associada a infra-estruturas eléctricas, entre 1990 e 2006. A principal causa de morte é a colisão com os cabos e não tanto a electrocussão. Em Portugal foi detectado um caso de um abutre-preto morto devido a colisão com uma linha eléctrica de alta tensão, estimando-se uma média de quatro acidentes deste tipo, por ano, com esta espécie.
(3) Abate ilegal:
A perseguição directa pelos caçadores e colectores foi um problema no passado. Porém, nos dias de hoje, ocasionalmente alguns abutres-pretos são intencionalmente abatidos pelo preconceito de serem predadores. Embora não se registem muitos casos de animais abatidos, numa população tão reduzida, a morte de qualquer indivíduo pode afectar negativamente a conservação da espécie.
(4) Redução da disponibilidade alimentar:
Existe também uma correlação directa entre a distribuição de abutre-preto e a abundância relativa de gado. O abandono das práticas agrícolas tradicionais tem tido um efeito negativo na espécie, pois levou a um decréscimo muito acentuado no número de cabeças de gado disponíveis. O facto de se manter o gado dentro de instalações durante o Inverno e, principalmente, de se remover as carcaças dos animais do campo, também tem contribuído em muito para a diminuição da disponibilidade de alimento para os abutres.
(5) Alteração do habitat:
A alteração dos habitats de reprodução está frequentemente relacionada com as práticas silvícolas, que incluem: destruição de florestas nativas e florestação com espécies exóticas, derrube de árvores durante a época de reprodução, construção de trilhos para extrair madeira e corta-fogos, etc. À parte dos efeitos directos que estas acções têm no habitat, algumas destas actividades causam perturbação nas zonas de reprodução de abutre-preto e facilitam o acesso a nichos outrora inacessíveis.
Adicionalmente, o tempo extremamente seco que tem predominado na Europa nos anos recentes aumentou consideravelmente o número e extensão dos fogos florestais, especialmente na região do Mediterrâneo. As mudanças socioeconómicas e o abandono dos terrenos também contribuíram em muito para a frequência dos mesmos. Um fogo pode ter um efeito devastador no habitat do abutre-preto, como foi o caso do fogo que afectou uma colónia de abutre-preto na Andaluzia em 1992, destruindo oito ninhos com crias, bem como 21 plataformas vazias.
(6) Perturbação humana:
A perturbação humana tem sido descrita como um factor limitante, principalmente no Cáucaso, onde o turismo de montanha é muito popular. A perturbação durante a incubação tem resultado na perda de muitos ovos por abandono dos adultos e para a predação pelos corvos.
Em Portugal, o principal risco de perturbação humana advém de actividades realizadas na proximidade dos ninhos durante o período de reprodução, o que pode levar ao abandono de ovos e crias. Algumas das actividades potencialmente perturbadoras são realizadas inadvertidamente e estão associadas às práticas florestais (cortes, desmatações), cinegéticas e recreativas.
(7) Parques eólicos e Infra-estruturas hidráulicas
A instalação de parques eólicos nas proximidades dos locais de nidificação da espécie é considerada como uma ameaça importante devido à perturbação provocada quer durante a fase de construção (ao nível da abertura de acessos e colocação de infra-estruturas), quer durante a fase de exploração, dada a possibilidade de aumento da presença humana associada à abertura de acessos. Essas unidades de produção de energia eléctrica, dependendo da tipologia e localização dos aerogeradores, podem ainda, durante a fase de exploração, constituir uma causa de mortalidade desta espécie devido à colisão com as pás dos aerogeradores, em especial se estes forem instalados nas zonas importantes em termos de nidificação e dispersão de juvenis, ou ainda nas zonas de alimentação situadas nas cumeadas das serras. Os traçados eléctricos que estão associados aos parques eólicos constituem outro problema importante devido aos subsequentes riscos de colisão e electrocussão.
A instalação de infra-estruturas hidráulicas e, consequentemente, o aumento de caudal nos cursos de água, contribui para a inundação dos habitats de alimentação e reprodução, além de originar um aumento de perturbação nestas áreas (caso da Espanha e Grécia).
(8) Resíduos medicamentosos
O impacto negativo dos produtos tóxicos e contaminantes é um dos principais problemas de conservação da fauna selvagem em todo o mundo, devido às suas implicações em quase todos os aspectos fisiológicos e comportamentais dos indivíduos. A recente morte massiva de grifos por falência renal após a ingestão de carcaças de vacas tratadas com Diclofenaco (Voltaren®) no sudeste asiático, demonstra a acção nefasta que os resíduos de medicamentos podem ter quando os abutres ingerem cadáveres de origem doméstica. Se os abutres têm acesso a carcaças de animais que foram tratados e morreram antes do fim do período de eliminação do fármaco, facilmente entrarão em contacto com os resíduos medicamentosos. O consumo, por parte dos abutres, dos resíduos de medicamentos que estão a ser utilizados na pecuária actual, pode provocar a sua morte, lesões em órgãos internos, imuno-depressão e problemas reprodutores por danos aos embriões. De todos estes fármacos destacam-se os antibióticos, pela frequência com que são utilizados, pois podem deprimir o sistema imunológico e causar alterações na flora bacteriana comensal, promovendo a aquisição e proliferação de patogénicos. De forma adicional, se as concentrações de antibiótico ingeridas forem baixas, aumenta a possibilidade de criar bactérias resistentes aos antibióticos, o que contribui para o agravamento de um dos principais problemas de saúde pública da medicina actual em todo o mundo.
Bibliografia útil
• Bernis, E. (1966). El Buitre Negro (Aegypius monachus) en Ibéria. Ardeola, 12: 45-99.
• BirdLife International (2004). Birds in the European Union: a status assessment. Wageningen, The Netherlands: BirdLife International.
• Brandão R. (2003). Mortalidade de fauna silvestre por envenenamento em Portugal: resultados da análise retrospectiva entre 1992 e 2003. Actas do IV Congresso de Ornitologia da SPEA/ II Jornadas Ibéricas de Ornitologia. Aveiro, Portugal.
• Cabral, Maria João et al, Ed. (2005). Livro Vermelho dos Vertebrados de Portugal – Peixes Dulciaquícolas e Migradores, Anfíbios, Répteis, Aves e Mamíferos. Instituto da Conservação da Natureza, Lisboa.
• Carrete, M. & Donázar, J.A. (2005). Application of central place foraging theory shows the importance of Mediterranean dehesas for the conservation of the cinereous vulture, Aegypius monachus. Biological Conservation, 126: 582-590.
• Costillo, E., Corbacho, C., Morán, R. & Villegas, A. (2007). The diet of the black vulture Aegypius monachus in response to environmental changes in Extremadura (1970-2000). Ardeola, 42: 197-204.
• Cramp, S. and Simmons, K. E. L. (1980). Handbook of the birds of Europe, the Middle East and Africa. The birds of the western Palearctic vol II: hawks to bustards. Oxford, U.K.: Oxford University Press.
• de la Puente, J., Moreno-Opo, R. y Del Moral, J. C. 2007. El buitre negro en España. Censo Nacional (2006). SEO/BirdLife. Madrid.
• del Hoyo, J., Elliott, A. & Sargatal, J. (eds) (1994). Handbook of the Birds of the World. Vol2: New World Vultures to Guineafowl. Lynx Edicions. Barcelona, Spain.
• Donázar, J.A. (1993). Los Buitres Ibericos, Biologia y Conservacion. Reyero, J.M. (ed). Quercus. Madrid, Spain.
• Donázar J.A., Margalida A., Campión D. (2009). Buitres, muladares y legislación sanitaria: perspectivas de un conflicto y sus consecuencias desde la biología de la conservación. Sociedad de Ciencias Aranzadi. Donostia, España.
• Equipa ATLAS (2008). Atlas das Aves Nidificantes em Portugal (1999-2005). Instituto da Conservação da Natureza e da Biodiversidade, Sociedade Portuguesa para o Estudo das Aves, Parque Natural da Madeira e Secretaria Regional do Ambiente e do Mar. Assírio & Alvim, Lisboa.
• González, L.M. (1994). Cinereous Vulture Aegypius monachus. In: Tucker, G.M. & Heath, M.F. Birds in Europe: their conservation status. BirdLife Conservation Series No. 3. BirdLife International. Cambridge, UK. pp. 158-159.
• Heredia, B. (1996). Action plan for the cinereous vulture (Aegypius monachus) in Europe. In: Heredia, B., Rose, L. & Painter, M., (eds) Globally threatened birds in Europe: action plans. Council of Europe and BirdLife International. Strasbourg, France. pp. 147-158.
• Hernández, M. & Margalida, A. (2008). Pesticide abuse in Europe: effects on the cinereous vulture (Aegypius monachus) population in Spain. Ecotoxicology, 17: 264-272.
• ICN. (2006). Plano sectorial da Rede Natura 2000. Instituto da Conservação da Natureza. Lisboa, Portugal.
• Jung, K., Kim, Y., Lee, H. & Kim, J.-T. (2009). Aspergillus fumigatus infection in two wild Eurasian black vultures (Aegypius monachus Linnaeus) with carbofuran insecticide poisoning: a case report. The Veterinary Journal, 179: 307-312.
• Kim, J.-H., Chung, O.-S., Lee, W.-S. & Kanai, Y. (2007). Migration routes of cinereous vultures (Aegypius monachus) in northeast Ásia. Journal of Raptor Research, 41: 161-165.
• MacKinnon, J., & Phillipps, K. (2000). A Field Guide to the Birds of China. Oxford University Press.
• Moreno-Opo, r. y Guil, F. (Coords.) 2007. Manual de gestión del hábitat y de las poblaciones de buitre negro en España. Dirección General para la Biodiversidad. Ministerio de Medio Ambiente. Madrid, España.
• Nam, D.-H. & Lee, D.-P. (2009). Abnormal lead exposure in globally threatened Cinereous vultures (Aegypius monachus) wintering in South Korea. Ecotoxicology, 18: 225-229.
• Rufino, R. (1989). Atlas das Aves que nidificam em Portugal Continental. Centro de Estudos de Migrações e Protecção de Aves. Serviço Nacional de Parques Reservas e Conservação da Natureza. Lisboa, Portugal.
• Silva, L., Pais, M.C. & Safara, J. (1996). Recent data on the situation of the Black Vulture in Portugal. R.R.F. 2nd International Conference on Raptors. Urbino, Italy.
• Snow, D. W. & Perrins, C. M. (1998). The Birds of the Western Palearctic Concise Edition.
• Skartsi, T., Elorriaga, J.N., Vasilakis, D.P. & Poirazidisa, K. (2008). Population size, breeding rates and conservation status of Eurasian black vulture in the Dadia National Park, Thrace, NE Greece. Journal of Natural History, 42: 345-353.
• Vasilakis, D., Poirazidis, C. & Elorriaga, J. (2006). Breeding season range use of a Eurasian Black Vulture Aegypius monachus population in Dadia National Park and the adjacent areas, NE Greece. - In Piper, S. & Houston, D. (eds) Proceedings of the international conference on the Conservation and Management of Vulture Populations. WWF Hellas-Natural History Museum of Crete. Salonica, Greece. pp. 127-137.
• Villegas, A., Sánchez-Guzmán, J.M., Costillo, E., Corbacho, C. & Morán, R. (2004). Productivity and fledgling sex ratio in a cinereous vulture (Aegypius monachus) population in Spain. Journal of Raptor Research, 38: 361-366.